- · 《中国疫苗和免疫》栏目[09/30]
- · 《中国疫苗和免疫》数据[09/30]
- · 《中国疫苗和免疫》收稿[09/30]
- · 《中国疫苗和免疫》投稿[09/30]
- · 《中国疫苗和免疫》征稿[09/30]
- · 《中国疫苗和免疫》刊物[09/30]
免疫新秀又在憋大招,个体化肿瘤疫苗在各大癌
作者:网站采编关键词:
摘要:目前,全球疫苗好消息频频传来!据了解,全球8款新冠疫苗进入临床试验,4款来自中国团队,截止到4月2日,在武汉进行的新冠疫苗一期临床试验的108位受试者已完成接种。疫苗无疑是
目前,全球疫苗好消息频频传来!据了解,全球8款新冠疫苗进入临床试验,4款来自中国团队,截止到4月2日,在武汉进行的新冠疫苗一期临床试验的108位受试者已完成接种。疫苗无疑是人类与疾病斗争最具里程碑意义的发明之一,同样的在癌症的治疗过程中,疫苗也发挥了举足轻重的作用!
近年来,树突细胞疫苗的发展可谓是突飞猛进,发展迅速,而且越来越多的临床研究公布的数据足以让医学家们为之振奋!
更让人惊喜的是,5月7日,Immunicum AB公司宣布,美国食品和药品管理局(FDA)已授予其先导候选药物已授予其先导候选药物ilixadencel(伊利沙定)治疗转移性肾细胞癌(mRCC)的再生医学先进疗法(RMAT)资格。这预示着个体化疫苗将会迎来“百花齐放”的时代!
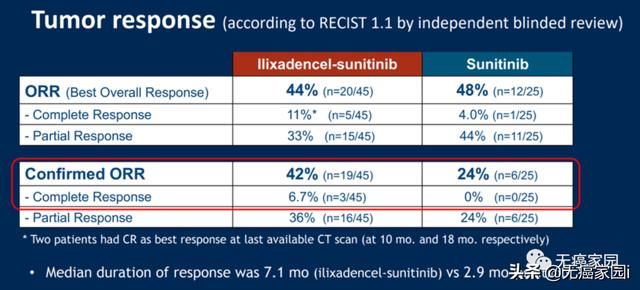
总缓解率翻倍,ilixadencel疫苗有望跻身一线治疗提及前面说到的ilixadencel,大家可能有些陌生,这是一种同种异体树突状细胞(DC)疫苗。就在前不久落幕的2020年ASCO-SITC临床免疫肿瘤学会议上公布了最新的全球性II期MERECA临床试验(NCT0)数据显示,ilixadencel联合靶向抗癌药舒尼替尼(索坦,通用名:sunitinib)一线治疗新诊断的晚期转移性肾细胞癌(mRCC)患者,与单独采用舒尼替尼治疗的患者相比,总缓解率提高一倍,完全缓解率更高,缓解更加持久!
相关链接:完全缓解率大幅提升!新型癌症疫苗前景无限!
此项试验的数据截止到2019年12月,88例患者中最终有70例患者可评估,
1总缓解率(ORR):42% vs 24%
ilixadencel联合治疗组客观缓解率为42%,而舒尼替尼组仅为24%,将近翻了一倍;
2完全缓解率(CR):11% vs 4%
ilixadencel联合治疗组中有5名完全缓解者(11%),随访30~33个月时,他们全部还活着。而在仅接受舒尼替尼的对照组中,仅有1名完全缓解者(4%),但在41个月后死亡。
3总生存率(OS):54% vs 37%
ilixadencel联合治疗组的总生存率为54%,而舒尼替尼单药治疗组为37%;
4反应持续时间(DOR):7.1个月 vs 2.9个月
ilixadencel持续中位反应时间为7.1个月,舒尼替尼仅为2.9个月,将近延长了3倍;
5中位无进展生存期分别为11.8个月 vs 11.0个月
关于ilixadencel疫苗
ilixadencel是一种同种异体树突状细胞(DC)疗法,目前正被开发为一种现成的(即用型)癌症免疫触发剂,其活性成分是来源于健康献血者的树突状细胞,这些细胞被特别激活,可产生大量强有力的免疫刺激因子。通过肿瘤内注射给药后,这些细胞会引起局部炎症反应,招募和活化患者自身的DC细胞和自然杀伤细胞(NK)进入肿瘤环境中,破坏肿瘤细胞,启动患者自身对肿瘤的免疫过程。
此项研究可以看出,ilixadencel联合舒尼替尼一线治疗晚期肾癌,可以大大提高治疗的有效率,患者的总生存率和完全缓解率,并且更加安全。这款新型的疫苗潜力无限,共针对6种癌症类型,包括肾癌、肝癌、胃肠道间质瘤、头颈部肿瘤、非小细胞肺癌和胃癌等实体肿瘤,我们期待进一步的临床数据,希望这款疫苗能早日上市造福患者。
树突疫苗进军胶质母细胞瘤,15个月OS率达76%2020年4月8日,开发免疫疗法的Aivita Biomedical公司公布了关于新型免疫疗法AV-GBM-1的II期临床试验数据,研究显示此款新型疫苗对延长新诊断的胶质母细胞瘤患者的中期总体生存期展现出极大的潜力。
在接受AV-GBM-1治疗的50例可评估患者的15个月的总生存率为76%,而对照组的287例接受标准治疗的患者的12个月和15个月的总生存率分别为61%和48%。这表明,接受AV-GBM-1治疗的患者15个月的总生存率提高了28%,疗效格外显著。
在2019年刚过去的肿瘤免疫治疗年会上,此项研究结果表示,在接受标准治疗后给予载有自体肿瘤抗原的自体数体细胞的研究性疫苗作为辅助治疗是安全可行的。
Aivita首席医学官Robert O. Dillman医学博士解释道:AV-GBM-1是一种患者自体的特异性树突状细胞疫苗,在胶质母细胞瘤的标准护理治疗后可作为辅助治疗方案,标准治疗包括手术切除,然后放射治疗和替莫唑胺联合治疗。
这种树突细胞疫苗能够携带术后肿瘤组织中提取的特定抗原信息,注射后,将抗原信息传递给T细胞,激发起杀瘤活性。针对患者的自体疫苗虽然在逻辑上很复杂,但是是一种可行的方法,能够与替莫唑胺和放射治疗同时进行;也可以从化疗和放疗中恢复后再注射AV-GBM-1疫苗。患者如果能够成功进行单科白细胞收集,则年龄在70岁以下都有资格参加研究。
文章来源:《中国疫苗和免疫》 网址: http://www.zgymhmy.cn/zonghexinwen/2020/1012/379.html